起於 2019 年末,全球大流行的新型冠狀病毒肺炎 (新冠肺炎/COVID-19)是由嚴重急性呼吸系統綜合症冠狀病毒 2 (SARS-CoV-2) 引起。截至 2021 年 10 月中旬,此災難性的病毒已感染約 2.2 億人,造成超過 450 萬人病故。自 COVID-19 爆發以來,迫切需要確認導致其快速傳播以及感染患者高重症率和死亡率的病因因素和分子生物學基礎。最近,通過對病毒基因組的序列分析與冷凍電子顯微鏡和 X 射線晶體學測定病毒蛋白質的結構,所收集到的數據得以一窺 SARS-CoV-2 發病機制的分子動力學奧秘。這些病毒學發現對研擬開發預防疾病傳播和惡化的疫苗和治療的策略大有裨益。
|
新型冠狀病毒的刺突(S)蛋白及它如何介導病毒進入細胞 |
病毒感染的關鍵起始步驟是附著在宿主細胞上的受體。而冠狀病毒的進入細胞的過程大致可分為兩個步驟:一是S蛋白與特定表面受體的結合,然後S蛋白被細胞蛋白酶切割以促進與細胞膜融合和病毒攝取。SARS-CoV-2 主要使用血管收縮素轉化酶2 (ACE2) 作為受體和跨膜絲胺酸蛋白酶2 (TMPRSS2) 和宿主體內到處存在的弗林蛋白酶作為協同蛋白酶進入細胞。免疫組織染色和 RNA 測序研究觀察到呼吸道和胃腸道的上皮細胞表達大量的 ACE2 和 TMPRSS2。
SARS-CoV-2 於受體結合時相互作用特徵的動態景觀繪製工作(圖 1)表明S蛋白在新包裝的病毒粒子上以亞穩態三聚體形式存在,在不同構型狀態之間變換。S蛋白包含兩個功能亞基,稱為「S1」和「S2」(圖 2)。受體結合域 (RBD) 位於球狀 S1 頭部,對 ACE2 表現出低於5奈莫耳範圍的親和力。在與受體融合前狀態,分子結構靈活的 S1 RBD 可以做類似鉸鏈的運動,切換於兩種構型間:大部分時間為「向下/閉合」構型,此時 RBM (受體結合基序)受到掩蓋,無法觸及受體; RBM 顯露外的「向上/開放」構型僅片刻得見。
ACE2 結合觸發S三聚體向融合後模式的全面狀態轉變。與之前 SARS-CoV 的 S蛋白相比,SARS-CoV-2 的S蛋白在S1與S2亞基間的界面獲得了一個弗林類蛋白酶切割位點。受體結合後,由於弗林蛋白酶蛋白水解活性,S1亞基結構域與病毒體表面脫離。弗林蛋白酶促發性的切導致 TMPRSS2 在 S2' 位點進一步切割處理莖狀的 S2 亞基,隨後受切割的 S2 迅速重新折疊成穩定的融合後狀態。S2 亞基本身是一個機件集,由六個驅動膜脂質雙層融合所需的基序部件組成。第二道的 TMPRSS2 切割啟動融合機件集,接著疏水性融合肽 (FP) 基序嵌入到宿主細胞膜。在 S2 三聚體的大幅地結構重排過程中,兩個七肽重複序列(HR1 和 HR2)基序以反向平行的方式交疊相聯,形成一個六螺旋束 (6HB) 的構造。多個 6HB 協同作用下,將由 FR 插入的宿主細胞膜與由跨膜 (TM) 區域錨定的病毒封膜緊密並置,然後開通連接兩端的小脂質融合孔洞。通過逐步擴大的孔洞,致病性的病毒成分如核衣殼和 ORF1ab 多蛋白到達細胞內空間。
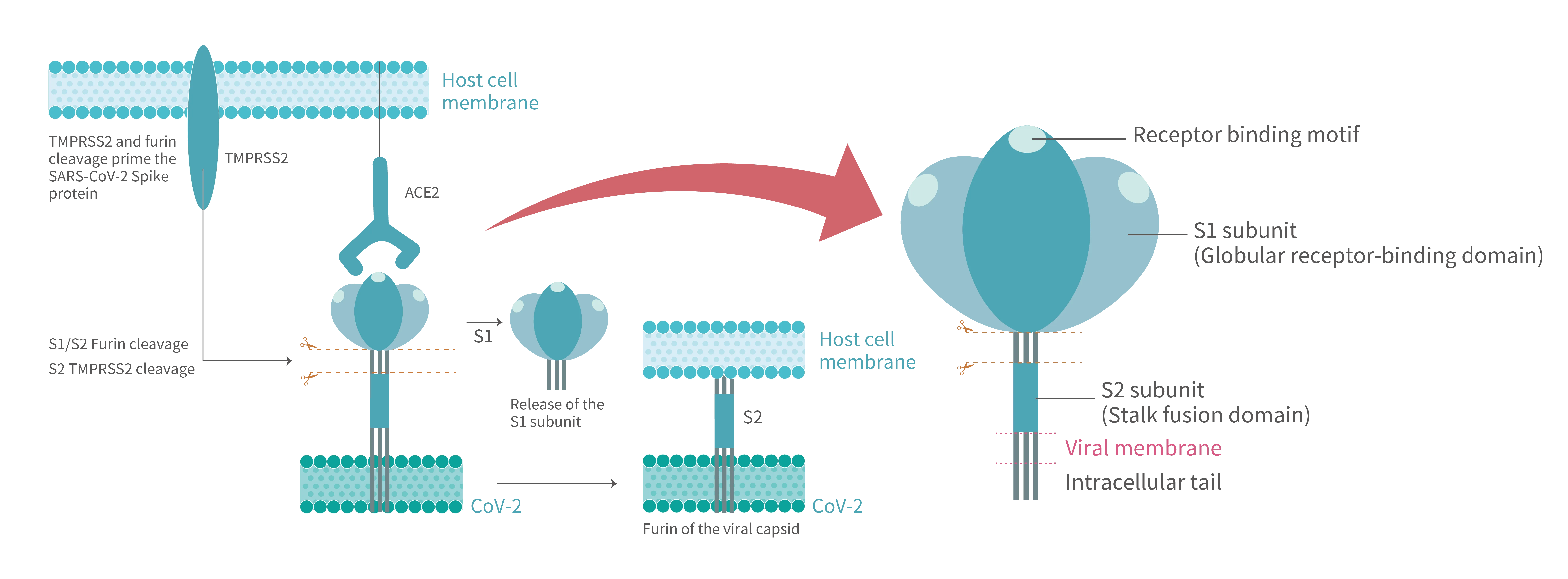 Figure 1. After SARS-CoV-2 S protein binds to the ACE2 receptor on host cell, where the viral entry process is primed by the cleavage of two protease,furin and TMPRSS2. Proteolytic activation of the spike trimer at the boundary sites between the S1 and S2 subunits dissociates the receptor-binding S1 domain and exposes the S2 domain required for mediating membrane fusion.
Figure 1. After SARS-CoV-2 S protein binds to the ACE2 receptor on host cell, where the viral entry process is primed by the cleavage of two protease,furin and TMPRSS2. Proteolytic activation of the spike trimer at the boundary sites between the S1 and S2 subunits dissociates the receptor-binding S1 domain and exposes the S2 domain required for mediating membrane fusion.
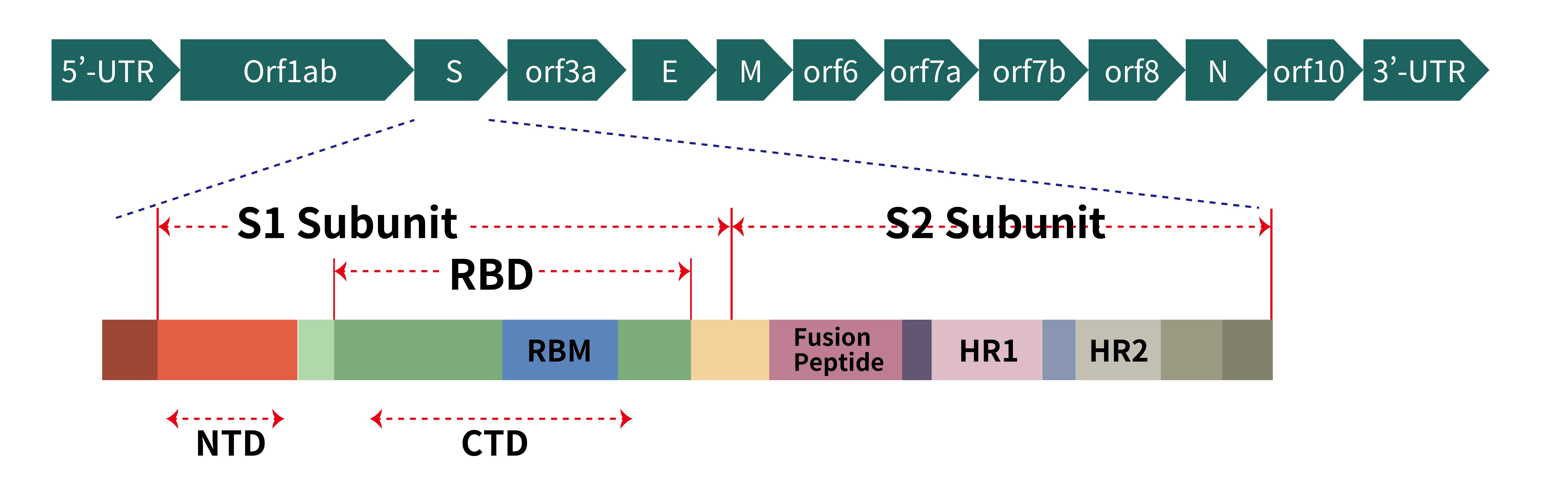
圖2. (a) Schematic representation of genome organization of SARS-CoV-2; (b) Schematic representation of the domain arrangement of the SARS-CoV-2 S proprotein. SS, signal peptide; NTD: N-terminal domain; RBD: receptor-binding domain; RBM: receptor-binding motif; SD1/2: subdomain 1 and 2; FP, fusion peptide; HR1, heptad repeat 1; CH, central helix; CD, connector domain; HR2, heptad repeat 2; TM, transmembrane domain; CT, cytoplasmic tail. Arrows denote protease cleavage sites. The SARS-CoV-2 S glycoprotein is synthesized as a 1273-amino acid polyprotein precursor.
|
新型冠狀病毒的第八號開放讀框的免疫病理學角色 |
SARS-CoV-2 是一種正股單鏈 RNA 病毒,其基因組約 30 kb,編碼冠狀病毒所有成員共有的蛋白質,如複製酶聚蛋白(pp1a 和 pp1b)和結構蛋白(尖峰、膜、核衣殼和包膜),許多抗病毒藥劑和預防性疫苗正針對前兩類物質開發。然而,SARS-CoV-2 基因組中還有 11 個輔助蛋白(圖 3)被指定為開放閱讀框 (ORF) 3a、3b、3c、3d、6、7a、7b、8、9b、9c 和 10所編碼,它們與其他已知冠狀病毒的病毒蛋白的序列同源性低。作為專性細胞內寄生生物,病毒可以利用多種機制來操弄或逃避宿主免疫系統以建立有效感染,並維持最佳複製寄宿龕位。雖然大多數輔助蛋白不直接參與病毒複製和入侵,但越來越多的證據表明,輔助蛋白可能作為毒力因子抑制免疫反應或攔截宿主細胞的物質代謝。具體來說,宿主免疫的一些關鍵分子的性質受到這些輔助蛋白的損壞。
體內每個細胞幾乎都可產生第一型干擾素(IFNs-I,常指IFN-α和IFN-β)用於防禦病毒感染。IFNs-I 通過抑制受病毒感染細胞的增殖和通過上調第一型主要組織相容性複合體分子 (MHC-I) 增強抗原呈獻來誘發抗病毒活性。此外,IFNs-I 介導先天性和適應性免疫細胞的多種相互作用,並激起稱為 IFN 刺激基因 (ISG)的基因集之表達。當病毒肽抗原被加載到 MHC-I,並顯露在細胞表面,細胞毒性 T 淋巴細胞(CTL 也稱為 CD8+ T 細胞)可藉此監測其存在,來偵測和破壞受病毒感染的細胞。換句話說,CTL 的細胞溶解功能是抗原特異性的,並且僅限於通過 MHC-I 呈遞。已有一些初步的分子機制被提出來解釋病毒輔助蛋白如何作為通過阻礙 IFNs-I 信號傳導和 MHC-I 組裝和運輸做為抵消細胞內抗原呈遞的措施。
SARS-CoV-2 ORF8 有 366 個核苷酸和 121 個胺基酸。在其 N端的前 17 個胺基酸已識別出一種用於內質網 (ER) 輸入的信息肽,但 ORF8 被證明是一種分泌型蛋白,並且在 COVID-19 患者中具有高度免疫原性。ORF8 還擁有一個具有推定免疫球蛋白 (Ig) 樣折疊的結構域,可能與多種宿主蛋白相互作用。與其他輔助蛋白的基因相比,ORF8 基因似乎更容易受到缺失和核苷酸取代的影響,因此產生了許多可能使病毒蛋白和宿主因子之間相互作用趨於複雜多樣的變體。
最近的研究表明,ORF8 可能與 MHC-1 分子結合且介導它們的調降。在表達 ORF8 的細胞中,MHC-1 分子被選擇性集中運往溶酶體進行降解。在嚴重的 COVID-19 患者中,先天免疫功能被破壞,其特徵是 IFN-I 反應功能障礙和持續性的高病毒載量。ORF8 可能與 ORF6 和 N蛋白協同發揮干擾素拮抗作用。綜上所述,ORF8的免疫調節特性使感染 SARS-CoV-2 的細胞對免疫細胞的識別和攻擊更具抵抗力。
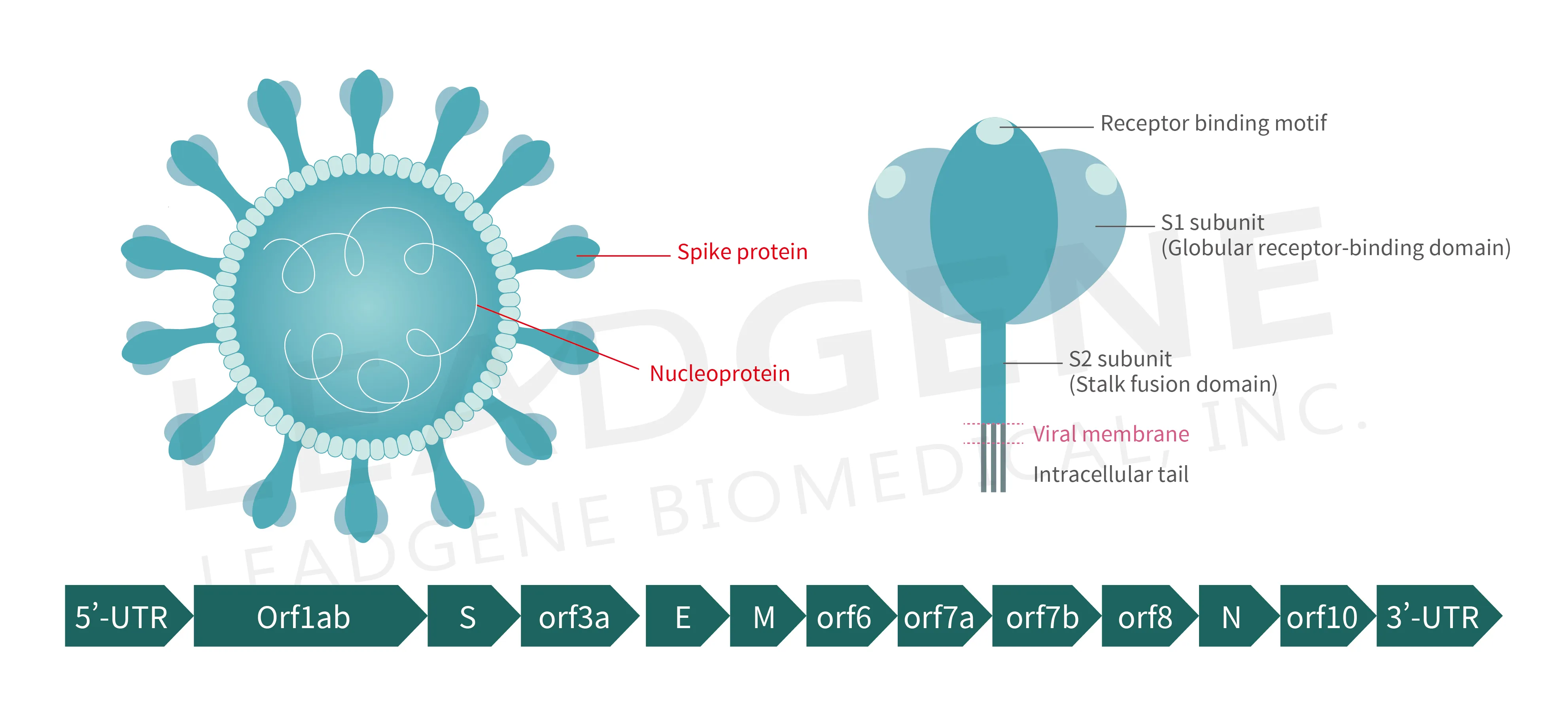
圖 3. SARS-CoV-2 病毒顆粒解剖構造和基因組組織示意圖
